La cicatrización es un proceso biológico con reacciones bioquímicas y mitóticas celulares, con tendencia a la curación y reparación de las ulceras y heridas, ya sea por primera intención o por segunda. La piel es el mayor órgano de nuestro cuerpo y cumple diferentes funciones:
La cicatrización es un proceso biológico con reacciones bioquímicas y mitóticas celulares, con tendencia a la curación y reparación de las ulceras y heridas, ya sea por primera intención o por segunda. La piel es el mayor órgano de nuestro cuerpo y cumple diferentes funciones:
• Mantener la integridad del cuerpo.
• Proteger de las agresiones externas.
• Absorber y excretar líquidos.
• Regular la temperatura.
• Impermeabilidad.
• Absorber radiación ultravioleta.
• Metabolizar la vitamina D.
• Detectar los estímulos sensoriales.
• Propiedades cosméticas.
• Función barrera frente a microorganismos.
• Interviene en mecanismos inmunológicos.
¿Qué es una herida?
 Es una pérdida de la continuidad de la piel o mucosa producida por algún agente físico o químico, que cursa con una serie de signos y síntomas, tales como separación de bordes de la piel, dolor, inflamación, hemorragia… etc. Las heridas agudas son de corta evolución y se caracterizan por una curación completa en un tiempo aproximado de 6 semanas, y están causadas por un agente externo traumático. En cuanto a las heridas crónicas, suele haber un componente endógeno principal, ya sea de origen metabólico o alguna enfermedad de base produciendo un retraso en el tiempo de curación y una ausencia de crecimiento de los tejidos, como; úlceras vasculares, úlceras diabéticas, procesos neoplásicos o iatrogénicas como las úlceras por presión
Es una pérdida de la continuidad de la piel o mucosa producida por algún agente físico o químico, que cursa con una serie de signos y síntomas, tales como separación de bordes de la piel, dolor, inflamación, hemorragia… etc. Las heridas agudas son de corta evolución y se caracterizan por una curación completa en un tiempo aproximado de 6 semanas, y están causadas por un agente externo traumático. En cuanto a las heridas crónicas, suele haber un componente endógeno principal, ya sea de origen metabólico o alguna enfermedad de base produciendo un retraso en el tiempo de curación y una ausencia de crecimiento de los tejidos, como; úlceras vasculares, úlceras diabéticas, procesos neoplásicos o iatrogénicas como las úlceras por presión
T I P O S D E C I C A T R I Z A C I Ó N
La cicatrización de heridas se puede dar de dos maneras:
– PRIMERA INTENCIÓN: se dará en heridas limpias no contaminadas, en las cuales se pueden aproximar bien, los bordes con una sutura precisa. Requiere una pequeña formación de tejido nuevo, su cicatriz es más estética.
– SEGUNDA INTENCIÓN: son heridas en las cuales se ha producido una pérdida de sustancia, si se suturarán se formaría un seroma debajo, con la posibilidad de acumular bacterias e infectarse la herida. También se produce este tipo de cierres en heridas contaminadas o infectadas.
 Independientemente de la naturaleza y el tipo de herida, la cicatrización requerirá los mismos procesos bioquímicas y celulares para su reparación, aunque con mayor o menor formación de tejido conectivo. La cicatrización comienza en el momento de producirse la lesión y su velocidad de reparación vendrá marcada por una serie de factores, como son:
Independientemente de la naturaleza y el tipo de herida, la cicatrización requerirá los mismos procesos bioquímicas y celulares para su reparación, aunque con mayor o menor formación de tejido conectivo. La cicatrización comienza en el momento de producirse la lesión y su velocidad de reparación vendrá marcada por una serie de factores, como son:– La superficie afectada.
– La profundidad.
– La zona anatómica afectada
– Infección.
– Alteraciones genéticas (hemofílicas, defectos en las metaloproteasas…).
– Enfermedades concomitantes.
– Administración de algunos fármacos.
A nivel nervioso, el traumatismo, va a desencadenar una serie de acontecimientos que supondrá el comienzo de la cicatrización. A nivel de la piel, las células sensoriales del dolor transmitirán la señal a través de sus inervaciones a la medula espinal y al encéfalo, se estimulará el sistema nervioso central causando dos tipos de respuesta, una motora refleja, de alejamiento del foco de dolor, y una respuesta emotiva, que afectará al sistema límbico generando una mezcla de emociones (miedo, angustia, rabia, tristeza, impotencia) que mezcladas con el dolor, explicarán la conducta del individuo. Además se producirá una respuesta autónoma del sistema nervioso simpático, liberando noradrenalina que provocará una vasoconstricción en la zona afectada, aumentando la fuerza miocárdica y la dilatación pulmonar.
El traumatismo supondrá una destrucción celular, se liberará su contenido, el cual será detectado por las células de Langerhans de la piel, que comenzarán a segregar sustancias quimioatractivas para los neutrófilos, monocitos y eosinófilos. Con ello, comenzará activarse el sistema inmunológico que estará en un estado de alerta por posibles entradas de agentes infecciosos que compliquen la situación.

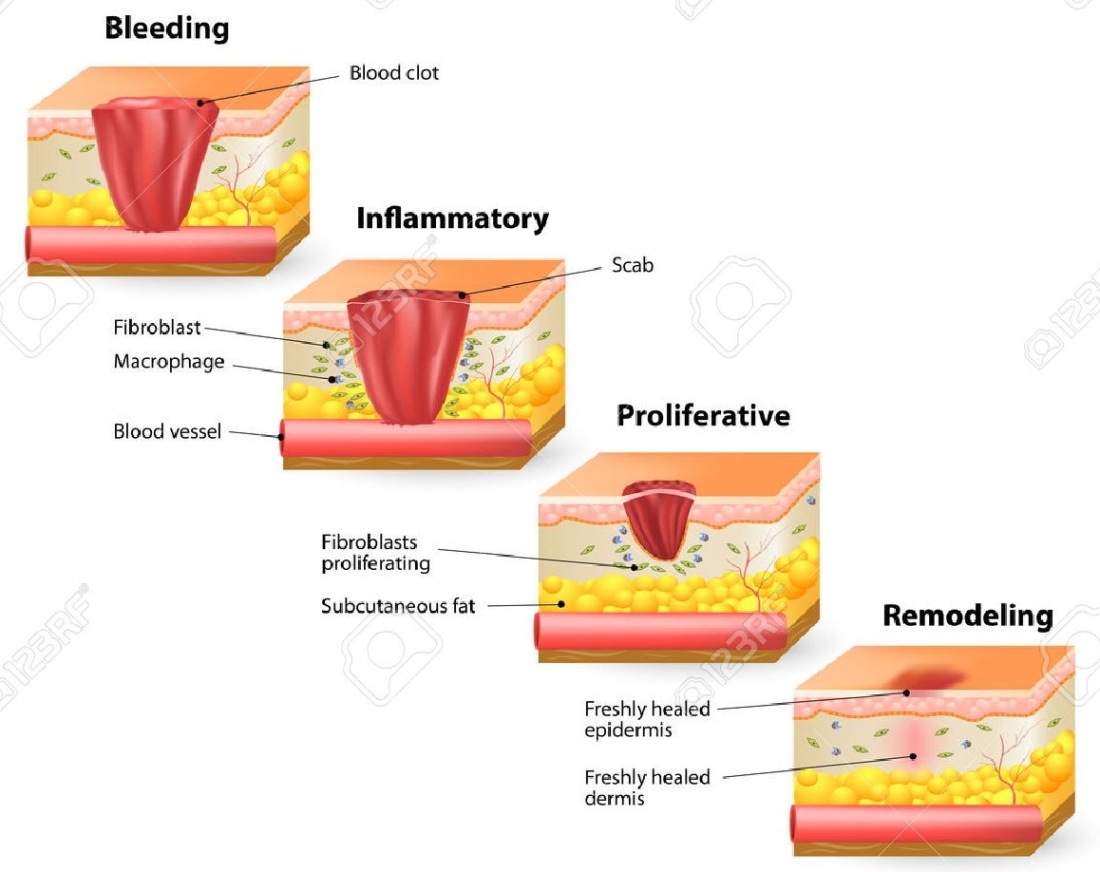
La hemostasia comienza con la contracción de la musculatura lisa de los vasos sanguíneos, gracias al sistema nervioso autónomo, disminuyendo el flujo sanguíneo a la zona afectada.
En condiciones normales, las células endoteliales segregan sustancias anticoagulantes, pero la rotura de los vasos va a provocar que este equilibrio se desestabilice y las células del endotelio comiencen a liberar sustancias agregantes, como el factor de Von Williebrand una glucoproteína que actúa de puente de unión entre las plaquetas y las fibrillas de colágeno. Estas primeras plaquetas se unirán y modificarán su estructura y segregarán sustancias que favorecerán la formación del trombo de fibrina.
La formación del trombo de fibrina se basa en una cascada de reacciones bioquímicas en la que intervienen trece factores distintos. Estos factores son enzimas inactivos compuestos por una molécula activadora, la serina, estos interaccionarán para activarse con otras sustancias, así poder interaccionar con el siguiente enzima inactivo. La formación de fibrina se puede dar por dos vías, la vía extrínseca que esta mediada por el factor de exposición tisular, liberado en el sitio de la lesión y que actuará como cofactor para la activación del factor X, esta reacción esta catalizada por el factor VII. Mientras que otra vía intrínseca se da por la activación de los factores XII y XI, estimulados por la agregación plaquetaria y el factor de Von Willebrand liberados por las plaquetas.
 Entonces, las dos vías se unen, para obtener el producto final que es la fibrina. Esta proteína filamentosa se une a las paredes de los vasos para formar una malla que atrapa los elementos plasmáticos impidiendo su extravasación y conseguir reestablecer la hemostasis en los capilares, además este coagulo de fibrina realizará una función fundamental para el inicio de la fase de proliferación, actuando de matriz provisional para la migración de los fibroblastos, durante la proliferación el coagulo será reabsorbido por los macrófagos para dar lugar a la matriz madura para la epitelización.
Entonces, las dos vías se unen, para obtener el producto final que es la fibrina. Esta proteína filamentosa se une a las paredes de los vasos para formar una malla que atrapa los elementos plasmáticos impidiendo su extravasación y conseguir reestablecer la hemostasis en los capilares, además este coagulo de fibrina realizará una función fundamental para el inicio de la fase de proliferación, actuando de matriz provisional para la migración de los fibroblastos, durante la proliferación el coagulo será reabsorbido por los macrófagos para dar lugar a la matriz madura para la epitelización.
Los mastocitos son los encargados de liberar histamina y heparina, con lo cual aumentará la vasodilatación de los vasos y su permeabilidad, de esta manera llegarán al lecho de la herida un mayor número de fibroblastos. Durante la inflamación, los neutrófilos y monocitos acudirán al lugar de la lesión atraídos por las células de Langerhans, los factores de agregación plaquetaria y la interleucina, segregados durante la coagulación.
Los neutrófilos son los primeros en acudir a la herida ya que son las células de defensa que más abundan en la sangre, liberarán enzimas (elastasas y colagenasa) que destruirán el tejido dañado, además por medio de la fagocitosis destruirán bacterias presentes en la herida, luego quedarán atrapados en el coagulo y sufrirán apoptosis.
Los monocitos, estimulados por interleucinas y fragmentos de la matriz extracelular, viajan como tales por el torrente circulatorio hasta llegar a la zona de la lesión. En la periferia vascular, estos monocitos quedarán unidos a la pared del endotelio, a través del cual, migrarán al lecho de la herida transformándose en macrófagos, convirtiéndose en el componente principal de limpieza de la herida y proliferación celular. Habrá macrófagos cuya función será de desbridamiento del tejido dañado, pero otros macrófagos reparadores sufrirán un cambio genético en su RNAm, cuya función principal será la de segregar citoquinas (factores de crecimiento e interleucinas), proteínas que dirigen las fases de la cicatrización y establecen el comienzo de una fase u otra, como el factor estimulante de colonias de granulocitos (G-CSF), el TNF-alfa, PDGF, TGF-alfa, IL-1, TGF-beta, IGF, estas sustancias estimularán a los fibroblastos y células epidérmicas para el cierre de la herida.
Los factores de crecimiento e interleucinas son liberados en la herida por plaquetas, macrófagos, linfocitos y células endoteliales. Es importante resaltar que los macrófagos segregan la mayoría de sustancias que favorecen la cicatrización, por lo tanto, se demuestra el papel importante que juegan en la transición de la inflamación a la reparación de la herida. El inicio de la proliferación celular, se inicia con la segregación de citoquinas y PDGF por parte de los macrófagos, estas sustancias estimularán la migración de los fibroblastos al lecho de la herida para formar la matriz extracelular, y la epitelización desde los bordes de la herida.
Los fibroblastos son células especializadas en la formación de fibras de colágeno y de sustancia fundamental, como el ácido hialurónico y los proteoglicanos. Estas células, gracias a sus receptores de fibronectina, migran por el coagulo y sintetizan colágeno estimulados por los factores de crecimiento e interleucinas, como el factor de crecimiento derivado de plaquetas (PDGF) o los interferones sintetizados por los linfocitos; cuando el tejido de granulación progresa, los macrófagos van reabsorbiendo el coagulo hacia el lecho de la herida, de tal manera que el coagulo va disminuyendo de grosor para dar paso al tejido conectivo de fibras de colágeno de tipo I, II, III.
No hay que olvidar que la migración fibroblástica va acompañada siempre de una neovascularización de la zona, los fibroblastos segregan factores angiogénicos, como el PDGF o IL-8, generando un ambiente idóneo para esta nueva formación capilar, y así aportar el oxígeno y los nutrientes necesarios para la síntesis de colágeno. El tejido de granulación adquiere una tonalidad rojiza debido a la intensa angiogénesis que se está realizando.
Mientras se está reabsorbiendo el coagulo, se está formando una nueva matriz, aunque aún no definitiva. Esta matriz intermedia está compuesta principalmente por fibroblastos, que sintetizan sustancias como colágeno de tipo I, II, III y la sustancia fundamental formada por ácido hialurónico y proteoglicanos. La formación de una matriz secundaria más estable, esta inducida por el TGFbeta, el ácido hialurónico disminuye y se produce un cambio en la estructura de los fibroblastos, su aparato de Golgi y su Retículo Endoplasmático aumentan de tamaño para producir un mayor número de proteínas, y se sintetiza un nuevo colágeno de tipo I, III, V, y también elastina para darle a la matriz un componente elástico, además hay un aumento en la síntesis de proteoglicanos. Una vez formada esta matriz, algunos fibroblastos adquirirán propiedades de músculo liso, son los miofibroblastos, que tienen la función de contraer la herida gracias a las miofibrillas formadas en su citoesqueleto. La contracción de la herida podrá ser de unos 0,6-0,7 mm/día.
Los fibroblastos, quedan unidos al colágeno y a los fragmentos de fibronectina, las fibras de colágeno a su vez se unen a los bordes de la herida, y de esta manera se forma una red por la cual podrá comenzar la epitelización de la herida. La angiogénesis que se ha ido formando paralelamente al tejido de granulación, se forma a partir de la periferia vascular. La membrana basal de las células endoteliales se rompen y estas células comienzan a proliferar, este proceso esta inducido por citoquinas segregadas por las propias células endoteliales y los fibroblastos como; el VEFG, PDGF, IL 8, TNF-alfa, FGF-2, TGF-beta. Los bordes de las células endoteliales se anastomosan para formar una nueva red de capilares, que con frecuencia sobresale a la superficie de la herida, dando lugar a unos pequeños gránulos rojos. Luego se diferenciarán en arteriolas y vénulas.
 La epitelización de la herida comienza al poco tiempo de haberse formado el tejido de granulación maduro. La transición dermo-epidérmica está gobernada sobre todo por los factores de crecimiento PDGF y KGF. Los queratinocitos proliferan desde los bordes de la herida hacia el centro, y están estimulados por factores de crecimientos liberados por las propias células epiteliales del borde de la herida, como; el factor de crecimiento epidérmico (EGF), factor de crecimiento transformante alfa (TGF-alfa), el factor de crecimiento fibroblástico (FGF) o el factor de crecimiento queratocítico (KGF). Las moléculas de unión desmosómicas y hemidesmosómicas de los queratinocitos desaparecen, y así poder proliferar a través de la matriz estable de colágeno, proteoglicanos y fibronectina. Para que los queratinocitos puedan transitar debe de haber un tejido de granulación maduro, por ello es indispensable la degradación de la fibrina por parte de los macrófagos. Los queratinocitos migran gracias a sus receptores de membrana que tienen gran afinidad por la fibronectina de la matriz extracelular. Al contactar células epiteliales entre sí, se forma de nuevo la membrana basal y las proteínas de unión, para volver a una proliferación epidérmica normal. Durante esta fase, aparecen unos signos evidentes que nos indican que se está produciendo una epitelización de la herida, por ejemplo; la herida se sitúa al mismo nivel que la piel circundante, el lecho debe tener una tonalidad rojiza, y en los bordes de la herida aparece un epitelio rosado.
La epitelización de la herida comienza al poco tiempo de haberse formado el tejido de granulación maduro. La transición dermo-epidérmica está gobernada sobre todo por los factores de crecimiento PDGF y KGF. Los queratinocitos proliferan desde los bordes de la herida hacia el centro, y están estimulados por factores de crecimientos liberados por las propias células epiteliales del borde de la herida, como; el factor de crecimiento epidérmico (EGF), factor de crecimiento transformante alfa (TGF-alfa), el factor de crecimiento fibroblástico (FGF) o el factor de crecimiento queratocítico (KGF). Las moléculas de unión desmosómicas y hemidesmosómicas de los queratinocitos desaparecen, y así poder proliferar a través de la matriz estable de colágeno, proteoglicanos y fibronectina. Para que los queratinocitos puedan transitar debe de haber un tejido de granulación maduro, por ello es indispensable la degradación de la fibrina por parte de los macrófagos. Los queratinocitos migran gracias a sus receptores de membrana que tienen gran afinidad por la fibronectina de la matriz extracelular. Al contactar células epiteliales entre sí, se forma de nuevo la membrana basal y las proteínas de unión, para volver a una proliferación epidérmica normal. Durante esta fase, aparecen unos signos evidentes que nos indican que se está produciendo una epitelización de la herida, por ejemplo; la herida se sitúa al mismo nivel que la piel circundante, el lecho debe tener una tonalidad rojiza, y en los bordes de la herida aparece un epitelio rosado.
La maduración de este nuevo tejido conectivo, comienza a partir de la tercera o cuarta semana, gracias a una remodelación de las fibras de colágeno. Para que pueda producirse esta fase, la herida debe de estar cerrada completamente. Los capilares sufren una necrosis y son reabsorbidos por los macrófagos y su espacio es ocupado por fibras de colágeno. Para conseguir esta reorganización de las fibras, aparecen una serie de metaloproteasas con actividad colagenolítica que degradan el colágeno desnaturalizado y los proteoglicanos. Este proceso produce en la cicatriz un cambio en la textura de la piel, en el grosor y el color. La herida se contrae gracias a la acción de los miofibroblastos, llegando a una capacidad de contracción del 20% de la piel normal a los 21 días y hasta un máximo de contracción del 80% a los 6 meses. El tejido cicatrizal es un tejido poco vascularizado, sin pelo, sin glándulas sebáceas ni sudoríparas. Esta fase puede continuar a lo largo de los meses e incluso uno o dos años.
FACTORES QUE INFLUYEN EN LA CICATRIZACIÓN DE LAS HERIDAS
Factores generales:
– La edad: la velocidad de cicatrización es inversamente proporcional a la edad del paciente, e incluso en niños se suele producir cicatrices hipertróficas.
La edad: la velocidad de cicatrización es inversamente proporcional a la edad del paciente, e incluso en niños se suele producir cicatrices hipertróficas.
– La circulación sanguínea:
• Un aporte inadecuado de nutrientes y oxígeno a las células dificultará su actividad reparadora. Además, el humo del tabaco disminuye la presión parcial de oxígeno en la herida disminuyendo así la síntesis de colágeno, la angiogénesis y la actividad fagocítica.
• Un aporte insuficiente de glóbulos blancos, hace disminuir el desbridamiento del tejido dañado, por lo tanto menor descontaminación de la herida y de proliferación celular.
– La nutrición: para una mejor cicatrización se debe aumentar el consumo de alimentos ricos en proteínas, vitaminas A y C, y sales minerales como el Zn, Ca, Cu y el Fe esencial para la síntesis de DNA y la división celular.
– Enfermedades de base como:
• Diabetes: produce una alteración de los glóbulos blancos, entre otras anomalías.
• Arteriosclerosis: depósitos de lípidos y colesterol en las paredes de los vasos produciendo una disminución del aporte sanguíneo.
• Hipertiroidismo: disminuye la síntesis de colágeno.
• Insuficiencia renal crónica.
• Hipotiroidismo: disminuye la degradación del tejido y la síntesis de colágeno.
– Medicamentos como:
• Corticoides: interfieren en la migración y fagocitosis de los glóbulos blancos, disminuyendo la descontaminación de la herida.
• Povidona yodada y el agua oxigenada: puede retardar la cicatrización destruyendo células durante la fase proliferativa de la herida.
• Algunas hormonas: la progesterona favorece la angiogénesis, pero deprime la fibroplasia. Los estrógenos inhiben ambas fases.
Factores locales:
– Contaminación crítica, produce una fase de inflamación duradera en el tiempo, al aumentar las bacterias en la herida aumenta el número de glóbulos blancos, consecuentemente aumenta la permeabilidad de los vasos para facilitar el paso de leucocitos, produciéndose edema en el lugar de la lesión y una disminución del número de fibroblastos.
– Exceso de exudado que retrasa la proliferación de los fibroblastos, células endoteliales y queratinocitos ya que, estas enzimas alteran la sustancia fundamental de la matriz extracelular.
– La temperatura alrededor de la herida debe ser de 37 ºC pero si disminuye provoca una vasoconstricción, dificultando el aporte de glóbulos blancos a la herida y una alteración en el transporte de oxígeno y nutrientes. El contacto de la herida con el ambiente hace que disminuya su temperatura, tardando varias horas en recuperar su actividad reparadora y cicatricial.
– Deshidratación de la herida retrasa la cicatrización, por eso se recomienda realizar curas en ambiente húmedo. Si dejamos al descubierto la herida, posibilitamos la formación de una escara o costra, que actúa de barrera física para los queratinocitos, dificultando su migración al lecho ulceral. Además reduce la proliferación celular y su división.