Es importante comenzar por definir qué son las sondas, son instrumentos tubulares que sirven para alcanzar una cavidad del cuerpo a través de un orificio natural o artificial, con propósitos diagnósticos o terapéuticos. Pueden ser de látex, silicona u otro material sintético. No hay una definición precisa que permita delimitar las denominaciones de cánula, catéter o sonda aunque, en general, el nombre de cánula se reserva a accesorios de poca longitud.
Es importante comenzar por definir qué son las sondas, son instrumentos tubulares que sirven para alcanzar una cavidad del cuerpo a través de un orificio natural o artificial, con propósitos diagnósticos o terapéuticos. Pueden ser de látex, silicona u otro material sintético. No hay una definición precisa que permita delimitar las denominaciones de cánula, catéter o sonda aunque, en general, el nombre de cánula se reserva a accesorios de poca longitud.
¿Para qué nos sirve una sonda?
Una sonda puede servir para instilar líquido en una cavidad, o bien para extraerlo: sonda de drenaje. Su introducción en el organismo debe ser practicada sin traumatismo ni efracciones y con el mejor confort posible para el paciente cualquiera que sea la vía de acceso. Su diseño está adaptado a la finalidad prevista, ya sea alcanzar las vías respiratorias, genitourinarias, intestinales o rectales. Si se tienen en cuenta unas condiciones de esterilización, una indicación exacta y una realización cuidadosa no deben aparecer los problemas que históricamente se les achacan: los médicos temen infecciones de graves consecuencias y los pacientes torturas.
Aunque también es claro que cualquier procedimiento que le practiquemos debe ser explicado, con el objetivo de disminuir el temor a lo desconocido, al dolor o a la incomodidad que le pueda causar. El paso de una sonda produce dolor y molestia al deslizarse a través de cualquiera de los conductos a utilizar, por ello debemos darle a conocer lo que puede sentir, y explicar de qué manera se pueden minimizar estas molestias.
PARTES DE UNA SONDA
CABEZA
Es el extremo que se introduce en la cavidad orgánica. En ella figuran los orificios u ojos por los que se introduce o se extrae líquido. Los ojos pueden ser laterales o terminales y tendrán la forma y tamaño adecuado para evitar la posible obturación por mucosidades, coágulos. Las cabezas de las sondas tienen formas muy diversas. Según su función rectas, curvas, acodadas, etc.

CUERPO
Es la parte tubular de la sonda, cilíndrica y hueca. La talla se mide según su diámetro y se expresa en Charrière (Ch). Un Charrière es 1/3 de mm. Nº de Ch/3 = diámetro exterior en mm. Por ejemplo 6 Ch = 2 mm. La medida suele indicarse por el color del conectador de la parte proximal. 
ENLACE
Es el extremo de la sonda que queda en el exterior, sin ser introducido en el cuerpo. Se puede adaptar a una jeringa o a una bolsa recolectora, según su función de instalar o drenar. Los materiales utilizados normalmente en la fabricación de sondas vesicales son el látex y la silicona. El látex está indicado para sondajes cortos (2-3 semanas) y la silicona y el poliuretano para sondajes prolongados (3 meses aprox.).  Debido a las alergias que produce el látex, se ha incorporado el látex siliconado. Muchas sondas llevan una marca de contraste radiológico para saber donde se ha colocado.
Debido a las alergias que produce el látex, se ha incorporado el látex siliconado. Muchas sondas llevan una marca de contraste radiológico para saber donde se ha colocado.
CLASIFICACIÓN DE LAS SONDAS

Sondas genito-urinarias: vesicales y uretrales.
La longitud de penetración en el aparato urinario es el criterio diferenciador entre las sondas vesicales y uretrales.
Sondas vesicales. Se introducen a través de la uretra hasta la vejiga. Se utilizan con fines diagnósticos o para drenar orina o instilar un líquido en ella (medicamentoso o de lavado). La obtención de orina de la vejiga puede ser necesaria para exámenes bacteriológicos, sondeos de la uretra con una posible estrechez del lumen así como para obtener datos útiles en el diagnóstico de las vías urinarias bajas, por ejemplo la urodinámica y el ureterograma. Raramente sirve para la determinación de la orina residual porque actualmente esto se realiza por ultrasonido.
El sondaje terapéutico es necesario cuando hay alguna alteración al vaciarse la vejiga, por ejemplo durante el postoperatorio, en caso de “adenoma de próstata”. y para eliminar la retención de orina (vejiga neurógena), o por la estrechez en la uretra. Indicaciones del sondaje vesical/uretral
Los fines del cateterismo vesical pueden ser tanto diagnósticos como terapéuticos:
Fines diagnósticos: Exploración uretral o vesical, obtención de muestras de orina, medición del residuo postmiccional, control de la diuresis.
Fines terapéuticos: Alivio de la retención urinaria, tratamiento crónico de pacientes con fracaso en el vaciado vesical espontáneo cuando no hayan tenido éxito o no sean candidatos a ningún otro procedimiento alternativo, tratamiento de algunos pacientes con vejiga neurógena, administración de terapias endovesicales, postoperatorio de algunas cirugías (uretra, próstata, vejiga), fístulas vesicales y rotura vesical extraperitoneal, hematuria de origen vesicoprostático en pacientes que requieran lavados vesicales continuos, tratamiento intraoperatorio y postoperatorio de intervenciones quirúrgicas prolongadas o en pacientes de riesgo previsible de retención de orina, para posibilitar la curación más rápida de escaras de decúbito en pacientes incontinentes.
Contraindicaciones
- Prostatitis aguda.
- Uretritis aguda, flemones y abscesos periuretrales.
- Estenosis o rigidez uretral (valorar individualmente).
- Sospecha de rotura uretral traumática.
- Alergia conocida a los anestésicos locales o al látex.
Las sondas se definen por su longitud, su diámetro y por la forma de la punta de su cabeza: Las aberturas se denominan ojos, el número de ojos depende del flujo que se quiere que circule por la sonda.
- Punta de Nelaton: 2 ojos nivelados y punta hueca 2 ojos desnivelados y punta hueca.
- Punta de Tiemann: 1 ojo doblado y punta hueca acodada y fina, para sondajes difíciles por existir acodamientos o estenosis uretral.
- Punta de Couvelaire: 2 ojos nivelados y punta de flauta, para hematuria y absorción de coágulos.
- Punta de Dufour: 2 ojos desnivelados y punta de flauta.
- Punta de Mercier: 2 ojos desnivelados y punta hueca.
- Punta de Frohmüller: 3 ojos desnivelados y punta hueca.
El extremo proximal puede unirse a un tubo que conecte con una bolsa de recogida de orina, denominadas bolsas del sistema colector. 
LAS SONDAS VESICALES CON BALÓN O SONDAS FOLEY
 Tienen en su cuerpo un canal adicional para hinchar el terminal, que tiene forma de balón (de donde viene su denominación). Una vez colocada la sonda en la vejiga, se infla este «balón» por el canal adicional y así queda la sonda fija en la vejiga, ello es muy útil cuando se quiere que el paciente sondado pueda tener movilidad.
Tienen en su cuerpo un canal adicional para hinchar el terminal, que tiene forma de balón (de donde viene su denominación). Una vez colocada la sonda en la vejiga, se infla este «balón» por el canal adicional y así queda la sonda fija en la vejiga, ello es muy útil cuando se quiere que el paciente sondado pueda tener movilidad.
SONDAS CONDÓN
Las sondas condón se emplean con mayor frecuencia en los hombres mayores que sufren demencia. En lugar de colocar una sonda dentro del pene, se coloca un dispositivo sobre éste. La sonda va desde este dispositivo a una bolsa de drenaje. Esta sonda debe cambiarse todos los días.
LAS SONDAS URETRALES.
Sirven para el cateterismo de los uréteres. Se colocan con la ayuda de un citoscopio hasta alcanzar el uréter o riñón. Están graduados en cm para poder verificar la longitud de introducción y pueden ser opacas a los RX para poder ver su colocación por radiografía. Al igual que las sondas vesicales, disponen de distintas puntas, dependiendo de la utilización a que se destinen: punta cilíndrica, punta oliva o Chevassu. Su longitud es de unos 70 cm para adultos y los tamaños de fabricación van desde 3Ch al 12Ch.
SONDA LUBRICADA DE BAJA FRICCIÓN
Este tipo de sondas puede estar fabricada con un material tipo cloruro de polivinilo (PVC), que posteriormente se recubre con un lubricante formulado de polivinil-pirrolidona (PVP), cuyas moléculas se funden con la sonda en su totalidad. La lubricación de PVP es un polímero hidrosoluble que se activa cuando entra en contacto con el agua transformándose en una suave capa hidrofílica de consistencia inalterable, que se desliza fácil y suavemente a través de la uretra. La capa lubricante protege también el interior del corte del ojo de drenaje, contribuyendo aún más a disminuir la fricción y a minimizar el riesgo de trauma uretral al insertar y retirar la sonda. La ventaja más importante es que al conseguir un vaciado completo de la vejiga se reduce el riesgo de infección causada por el almacenamiento de orina durante un tiempo excesivo, así como preservar los riñones del daño que puede ocasionar un reflujo de orina. Los pacientes que han padecido episodios de incontinencia verán como se reduce este problema.
Tipos de sondaje:
Según el tiempo de permanencia del catéter se puede hacer esta diferenciación:
Sondaje intermitente y autosondaje: (ya sea único o repetido en el tiempo). la vejiga se sonda varias veces al día a intervalos de tiempo establecidos para cada paciente, con objeto de evitar distensiones-retenciones de orina e incontinencia. En algunas formas de parálisis laxa de la vejiga, en la incontinencia refleja y en las obstrucciones. El desarrollo de la técnica del sondaje vesical intermitente limpio consiste en la introducción de una sonda en la vejiga a través de la uretra para producir el vaciado vesical. Para conseguir una fácil inserción de la sonda, se requiere la utilización de un lubricante. Con el avance de la tecnología se han desarrollado sondas lubricadas de baja fricción. Permite a las personas con fallo de vaciado vesical de cualquier etiología vivir una vida prácticamente normal. La frecuencia del sondaje dependerá del volumen urinario diario y de la capacidad de la vejiga. En general, la media es de 3 a 4 sondajes diarios. Después de realizar el sondaje, se retira el catéter.
Son sondas flexibles y de una sola luz. (Nelaton, Tiemann)
- Sondaje temporal. Después de realizar el sondaje, el paciente permanece un tiempo definido con el catéter.
- Sondaje permanente. Después de realizar el sondaje, el paciente ha de permanecer indefinidamente con el catéter (con los recambios correspondientes). (Tipo Foley con balón)
Según el material del catéter:
El material con el que ha sido elaborado el catéter va a determinar sus características, que son las siguientes:
- Elasticidad.
- Coeficiente de fricción (preferiblemente bajo).
- Biodurabilidad (tiempo máximo de permanencia sin deteriorarse).
- Biocompatibilidad (capacidad de inducir reacciones o toxicidad).
- Tendencia a la incrustación (precipitación de mucoides y cristaloides).
- Tendencia a la adherencia bacteriana.
Los catéteres están hechos con biomateriales poliméricos que pueden ser naturales (látex) o sintéticos (cloruro de polivinilo, teflón, silicona u otros plásticos más modernos): • El látex ha sido el material de uso estándar, ya que es blando y maleable. Sin embargo, puede presentar incrustación rápida y toxicidad local con inducción de estenosis uretral. Su duración es de hasta 45 días.
• La silicona es más adecuada para el sondaje permanente, al ser más biocompatible (induce estenosis uretral con menor frecuencia) y muy resistente a la incrustación. Sin embargo, su excesiva flexibilidad obliga a fabricar catéteres de paredes gruesas y con orificios de drenaje pequeños, mientras que su permeabilidad permite el desinflado progresivo del balón de retención (lo que conduce a la pérdida de la sonda o al recambio precoz). Como los catéteres de silicona pura son más caros, la mayoría están fabricados con látex que se recubre con silicona o teflón para mejorar su tolerancia y facilitar su inserción. Pueden durar hasta 90 días.
• El cloruro de polivinilo (PVC) es un material más rígido y permite proporciones diámetro externo/interno óptimas para un drenaje adecuado. Es mejor tolerado que el látex y más barato que la silicona, aunque no es apto para el uso a largo plazo por la rápida incrustación que presenta.
• Los materiales más modernos de superficie hidrofílica, por su mayor biocompatibilidad y su menor coeficiente de fricción, reducen la irritación de la mucosa y la incrustación.
• El grado de adherencia bacteriana a la superficie del catéter es mayor con el látex y la silicona, variable con el teflón y escasa con los catéteres con superficie hidrofílica.
Según el calibre y la longitud de la sonda:
Debido a la diferencia anatómica que existe entre la uretra del hombre, tanto del adulto, adolescente o infantil y la de la mujer, existen diversos tipos de sondas para utilizar específicamente en cada caso. El calibre de la sonda se expresa según la escala francesa de Charrière (Ch), siendo un Ch equivalente a 0.33 mm. Son sinónimos de Ch las unidades French (FR) y French Gauge (FG). Los calibres disponibles se escalonan de dos en dos. La longitud varía dependiendo del tamaño de la uretra (varón, mujer o niños) y del propósito del cateterismo y se expresa en centímetros o en pulgadas (una pulgada equivale a 25 mm). Tanto en el pabellón de la sonda como en su envoltorio aparecen impresos el calibre y la longitud del catéter. La válvula a veces presenta un código de color para facilitar su identificación rápida.
En la elección del calibre de la sonda se tendrá en cuenta que la uretra del varón tiene un diámetro que oscila entre 20 a 30 Ch y la de la mujer entre 24 a 30 Ch. Una recomendación práctica es comenzar con una sonda de 18 Ch y, si hay dificultad, intentarlo con sondas más delgadas. Las medidas más habitualmente empleadas son los siguientes:
- Calibre: 8 Ch para los niños, entre 14 y 18 Ch para los hombres y entre 16 y 20 Ch para las mujeres.
- Longitud estándar: 41 cm (aunque en las mujeres y los niños la sonda puede ser más corta).
SONDA RECTAL

Se utiliza para facilitar la salida de gases a través del recto. Se fabrican en látex o plástico y tienen distintas longitudes, siendo la más normal de 30 cm. Las tallas más utilizadas son: Para niños (sondas pediátricas): 8 y 10 Ch. Para mujeres: 12, 14, 16, 18, 20, 22 y 24 Ch.
SONDA NASOGÁSTRICA
Sirven para alcanzar el estómago a través de la nariz, permitiendo introducir en los mismos alimentos o medicamentos (sondas Levin), o por lo contrario extraer el contenido mediante lavados, como el caso de intoxicaciones (sondas Faucher). En general, las sondas nasogástricas serán de gran diámetro para evitar las posibles obturaciones, por ello además se recomienda la administración de preparados lo más líquidos posible.  Procedimiento
Procedimiento
- Explicar al paciente la técnica que se va a realizar pidiéndole su colaboración.
- Reunir el material a utilizar
- Hacer una medición superficial del trayecto previsto (recorrido desde la nariz, parte posterior de la oreja y epigastrio), marcar éste punto con tela o con un lápiz.
- Situar al paciente en decúbito supino Fowler, incorporado a 45° y la cabeza ligeramente inclinada hacia delante.
- Lavarse las manos y preparar los materiales que utilizará la enfermera, aplicar suero a los 30 cms distales de la sonda.
- Colaborar en el procedimiento pidiéndole al paciente que trague saliva y aprovechando estos momentos de deglución avanzará la sonda.
- Una vez alcanzado el punto previsto en la medición inicial, puede empezar a salir contenido gástrico por la sonda; si esto no sucede, se aspirará con la jeringa, si se extrae contenido gástrico se confirmará su situación.
- Si aún no obtenemos contenido gástrico, se beberá introducir 20 cms. de aire con la jeringa, al mismo tiempo que auscultamos el epigastrio, intentando oír un ruido de burbujas en el estomago que indica la presencia de aire en la cavidad, o colocar el extremo libre de la sonda en un recipiente con agua, si hay burbujas indica que se encuentra en pulmones.
- Fijar la sonda con tela en la mejilla del paciente.
SONDAS INTESTINALES
Están destinadas a la aspiración intestinal en operaciones quirúrgicas, con el fin de disminuir la distensión abdominal dolorosa. Deben tener una gran longitud y un diámetro fino.
Para administrar la alimentación por sonda, se requiere un equipo específico.
- Contenedor de la fórmula: Se trata de una bolsa flexible o botella semirrígida, frascos de vidrios o latas y “tetrabricks” de material plástico. Deben tener una boca ancha para introducir la dieta y una salida donde se conecte, la línea de administración. Hoy en día muchos preparados comerciales ya se presentan en botellas que, mediante adaptadores adecuados, se conectan a la línea de administración sin necesidad de contenedores.
- Línea de Administración: Suele estar fabricada en plástico flexible y transparente; por un extremo se fija al contenedor o botella, y por el otro a la sonda. Intercalado en la línea se encuentran la cámara de goteo y el regulador de flujo o roller, situado por debajo de ésta, y que sirve para controlar la velocidad con que el líquido fluye a través de la sonda, cuando se administra la dieta por gravedad.
Existen dos tipos de líneas: para administración por gravedad y para administración con bomba. La diferencia fundamental consiste en que la línea de bomba tiene incorporado un segmento de silicona necesario para que la bomba pueda regular el flujo.Sonda para nutrición enteral. Las sondas se conectan al envase de NED. En general hay dos tipos de sondas para esta alimentación: las nasales y las gastro-yeyunostomía, de acceso directo al estómago o yeyuno. Las nasales se introducen por la nariz y pueden llevar la mezcla al estómago (sonda nasogástrica), duodeno (nasoduodenal) o yeyuno (nasoyeyunal). La sonda más utilizada es la nasogástrica. En la actualidad la mayoría de las sondas están fabricadas con silicona o poliuretano, pueden quedar colocada durante varios meses sin verse alteradas.
CONSEJOS DE UTILIZACIÓN:
– Aclarar la sonda antes y después de pasar alimentos con la ayuda de agua del grifo.
– Aclarar la sonda antes de introducir cualquier medicamento.
– Marcar con un rotulador que no se vaya con el agua, el punto de salida de la sonda por la nariz y asegurar que siempre se mantiene la misma fijación inmediatamente después de su colocación.
– Verificar su colocación durante el día sobre todo después de determinados esfuerzos como por ejemplo si se producen vómitos. Estas dos últimas verificaciones tienen por objeto evitar cualquier riesgo de que el alimento llegue a entrar en las vías aéreas del paciente.
Las sondas de polivinilo, que en los casos de lactantes pequeños pueden parecer más fáciles de colocar, se vuelven rígidas a corto plazo en contacto con las secreciones del organismo pudiendo producir irritación local. Las sondas pueden ser transparentes y radio opacas y deben ser finas y flexibles para minimizar las molestias y mejorar la tolerancia a largo plazo. El grosor o calibre de la sonda suele expresarse en “French” (FR) (ver capítulo de sondas), que representan el diámetro extremo: 1FR=1/3 de milímetro.
En prematuros y lactantes se utilizan tamaños de 5 o 6 FR, para niños mayores, 8fr y para adultos de 8 a 14 FR. La longitud de la sonda depende del tramo que queramos alcanzar (estómago, duodeno o yeyuno) suelen venir graduadas. La mayoría de las sondas miden entre 50 y 106 cm y son aptas para alcanzar el estómago y el duodeno, y en niños pequeños llegan a yeyuno. Para adultos, la longitud varía de 75 a 90 cm las naso gástricas y de 105 á 120 cm las nasoenterales.
Para facilitar la colocación de las sondas, éstas pueden llevar incorporado un fiador o guía, que suele ser un alambre muy fino que se extrae una vez implantada la sonda. Algunas sondas presentan en su extremo un pequeño peso llamado lastre, que habitualmente es de tungsteno y cuya función es ayudar a que la sonda alcance el duodeno y evitar que se mueva o forme bucles.
En el extremo opuesto al lastre, las sondas llevan incorporado un conectador que las une al sistema de aplicación. Cuando existen dos entradas, una sirve para la administración de alimentos y la otra para los medicamentos, el agua, aspiración, etc. El extremo final de las sondas acostumbra a ser redondeado e incorpora varios orificios de salida.
Las sondas de gastro-yeyunostomia: La colocación de una gastrostomía percutánea endoscópica se realiza, con anestesia local, cuando se considera necesaria una nutrición enteral a largo plazo (superior al mes y puede mantenerse hasta 2 años), o bien cuando es imposible el paso de una sonda por el esófago. Permite evitar una sonda naso gástrica poco estética, irritante o que puede ser retirada fácilmente por el mismo paciente si está agitado. 
SAMUEL ALFARO LÓPEZ #1 7 «A»




















 En la fase de respuesta aguda ocurre una respuesta inmediata al trauma, la cual se considera apropiada y adaptada, por medio de la intervención del sistema neuroendocrino. En la fase de respuesta crónica se desarrolla una respuesta endocrina a situaciones críticas prolongadas, denominándose maladaptadas y generándose un síndrome de desgaste sistémico. Sin embargo, la tendencia actual y la mejor manera de abordar la respuesta metabólica al trauma es en la que se considera el estado hemodinámico del paciente y las consecuencias sistémicas que implican. Estas fases son conocidas como fase Ebb, fase Flow, y fase anabólica.
En la fase de respuesta aguda ocurre una respuesta inmediata al trauma, la cual se considera apropiada y adaptada, por medio de la intervención del sistema neuroendocrino. En la fase de respuesta crónica se desarrolla una respuesta endocrina a situaciones críticas prolongadas, denominándose maladaptadas y generándose un síndrome de desgaste sistémico. Sin embargo, la tendencia actual y la mejor manera de abordar la respuesta metabólica al trauma es en la que se considera el estado hemodinámico del paciente y las consecuencias sistémicas que implican. Estas fases son conocidas como fase Ebb, fase Flow, y fase anabólica.












 La herida de bordes netos, limpios, sin lesiones de vecindad, se clasifica como simple, mientras que la herida de bordes irregulares con lesiones agregadas en planos profundos (vasculares, tendinosas, etc.) es llamada herida compuesta.
La herida de bordes netos, limpios, sin lesiones de vecindad, se clasifica como simple, mientras que la herida de bordes irregulares con lesiones agregadas en planos profundos (vasculares, tendinosas, etc.) es llamada herida compuesta. 

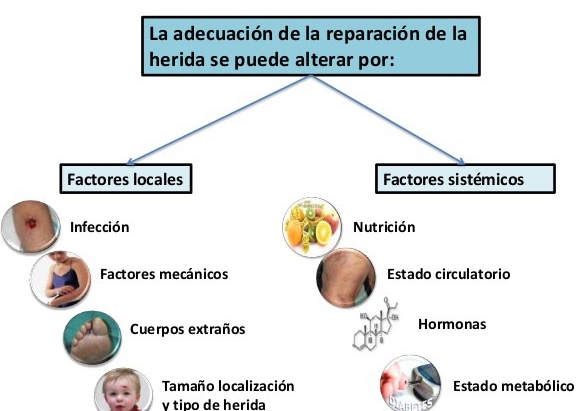
 La cicatrización es un proceso biológico con reacciones bioquímicas y mitóticas celulares, con tendencia a la curación y reparación de las ulceras y heridas, ya sea por primera intención o por segunda. La piel es el mayor órgano de nuestro cuerpo y cumple diferentes funciones:
La cicatrización es un proceso biológico con reacciones bioquímicas y mitóticas celulares, con tendencia a la curación y reparación de las ulceras y heridas, ya sea por primera intención o por segunda. La piel es el mayor órgano de nuestro cuerpo y cumple diferentes funciones: Es una pérdida de la continuidad de la piel o mucosa producida por algún agente físico o químico, que cursa con una serie de signos y síntomas, tales como separación de bordes de la piel, dolor, inflamación, hemorragia… etc. Las heridas agudas son de corta evolución y se caracterizan por una curación completa en un tiempo aproximado de 6 semanas, y están causadas por un agente externo traumático. En cuanto a las heridas crónicas, suele haber un componente endógeno principal, ya sea de origen metabólico o alguna enfermedad de base produciendo un retraso en el tiempo de curación y una ausencia de crecimiento de los tejidos, como; úlceras vasculares, úlceras diabéticas, procesos neoplásicos o iatrogénicas como las úlceras por presión
Es una pérdida de la continuidad de la piel o mucosa producida por algún agente físico o químico, que cursa con una serie de signos y síntomas, tales como separación de bordes de la piel, dolor, inflamación, hemorragia… etc. Las heridas agudas son de corta evolución y se caracterizan por una curación completa en un tiempo aproximado de 6 semanas, y están causadas por un agente externo traumático. En cuanto a las heridas crónicas, suele haber un componente endógeno principal, ya sea de origen metabólico o alguna enfermedad de base produciendo un retraso en el tiempo de curación y una ausencia de crecimiento de los tejidos, como; úlceras vasculares, úlceras diabéticas, procesos neoplásicos o iatrogénicas como las úlceras por presión Independientemente de la naturaleza y el tipo de herida, la cicatrización requerirá los mismos procesos bioquímicas y celulares para su reparación, aunque con mayor o menor formación de tejido conectivo. La cicatrización comienza en el momento de producirse la lesión y su velocidad de reparación vendrá marcada por una serie de factores, como son:
Independientemente de la naturaleza y el tipo de herida, la cicatrización requerirá los mismos procesos bioquímicas y celulares para su reparación, aunque con mayor o menor formación de tejido conectivo. La cicatrización comienza en el momento de producirse la lesión y su velocidad de reparación vendrá marcada por una serie de factores, como son: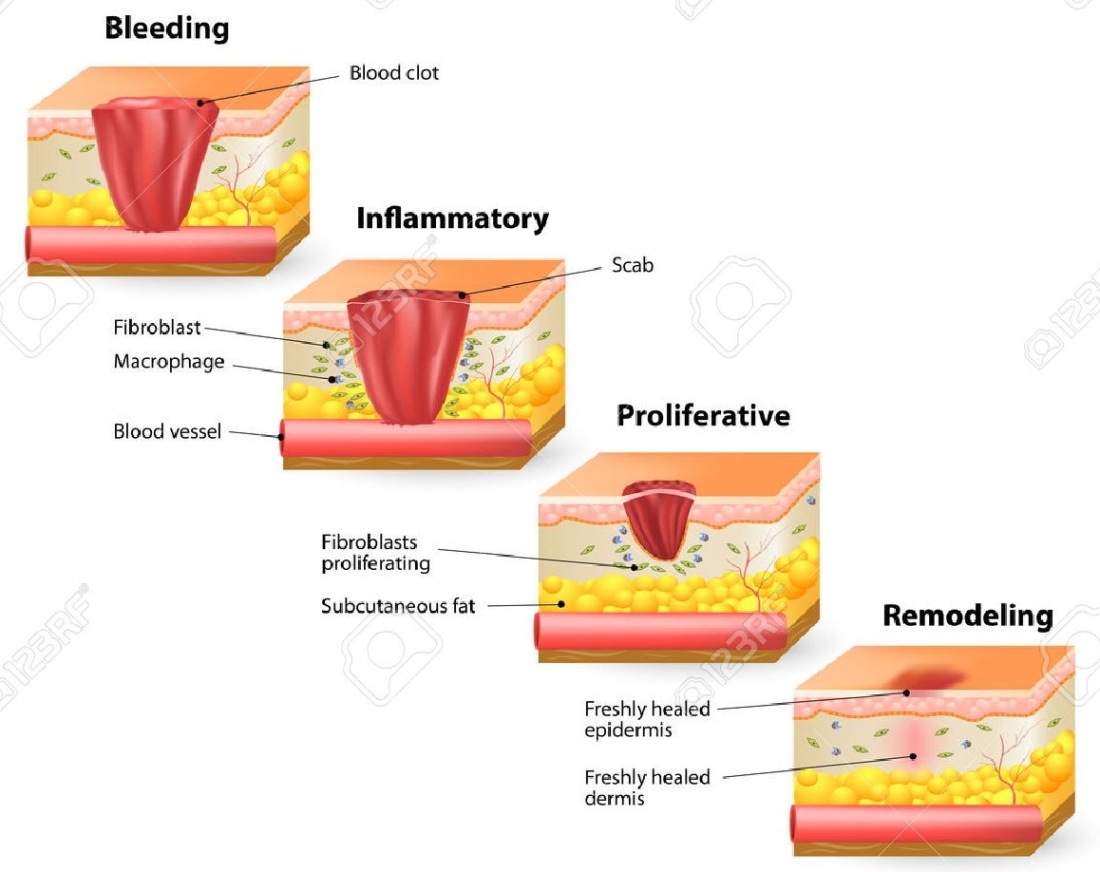

 Entonces, las dos vías se unen, para obtener el producto final que es la fibrina. Esta proteína filamentosa se une a las paredes de los vasos para formar una malla que atrapa los elementos plasmáticos impidiendo su extravasación y conseguir reestablecer la hemostasis en los capilares, además este coagulo de fibrina realizará una función fundamental para el inicio de la fase de proliferación, actuando de matriz provisional para la migración de los fibroblastos, durante la proliferación el coagulo será reabsorbido por los macrófagos para dar lugar a la matriz madura para la epitelización.
Entonces, las dos vías se unen, para obtener el producto final que es la fibrina. Esta proteína filamentosa se une a las paredes de los vasos para formar una malla que atrapa los elementos plasmáticos impidiendo su extravasación y conseguir reestablecer la hemostasis en los capilares, además este coagulo de fibrina realizará una función fundamental para el inicio de la fase de proliferación, actuando de matriz provisional para la migración de los fibroblastos, durante la proliferación el coagulo será reabsorbido por los macrófagos para dar lugar a la matriz madura para la epitelización. La epitelización de la herida comienza al poco tiempo de haberse formado el tejido de granulación maduro. La transición dermo-epidérmica está gobernada sobre todo por los factores de crecimiento PDGF y KGF. Los queratinocitos proliferan desde los bordes de la herida hacia el centro, y están estimulados por factores de crecimientos liberados por las propias células epiteliales del borde de la herida, como; el factor de crecimiento epidérmico (EGF), factor de crecimiento transformante alfa (TGF-alfa), el factor de crecimiento fibroblástico (FGF) o el factor de crecimiento queratocítico (KGF). Las moléculas de unión desmosómicas y hemidesmosómicas de los queratinocitos desaparecen, y así poder proliferar a través de la matriz estable de colágeno, proteoglicanos y fibronectina. Para que los queratinocitos puedan transitar debe de haber un tejido de granulación maduro, por ello es indispensable la degradación de la fibrina por parte de los macrófagos. Los queratinocitos migran gracias a sus receptores de membrana que tienen gran afinidad por la fibronectina de la matriz extracelular. Al contactar células epiteliales entre sí, se forma de nuevo la membrana basal y las proteínas de unión, para volver a una proliferación epidérmica normal. Durante esta fase, aparecen unos signos evidentes que nos indican que se está produciendo una epitelización de la herida, por ejemplo; la herida se sitúa al mismo nivel que la piel circundante, el lecho debe tener una tonalidad rojiza, y en los bordes de la herida aparece un epitelio rosado.
La epitelización de la herida comienza al poco tiempo de haberse formado el tejido de granulación maduro. La transición dermo-epidérmica está gobernada sobre todo por los factores de crecimiento PDGF y KGF. Los queratinocitos proliferan desde los bordes de la herida hacia el centro, y están estimulados por factores de crecimientos liberados por las propias células epiteliales del borde de la herida, como; el factor de crecimiento epidérmico (EGF), factor de crecimiento transformante alfa (TGF-alfa), el factor de crecimiento fibroblástico (FGF) o el factor de crecimiento queratocítico (KGF). Las moléculas de unión desmosómicas y hemidesmosómicas de los queratinocitos desaparecen, y así poder proliferar a través de la matriz estable de colágeno, proteoglicanos y fibronectina. Para que los queratinocitos puedan transitar debe de haber un tejido de granulación maduro, por ello es indispensable la degradación de la fibrina por parte de los macrófagos. Los queratinocitos migran gracias a sus receptores de membrana que tienen gran afinidad por la fibronectina de la matriz extracelular. Al contactar células epiteliales entre sí, se forma de nuevo la membrana basal y las proteínas de unión, para volver a una proliferación epidérmica normal. Durante esta fase, aparecen unos signos evidentes que nos indican que se está produciendo una epitelización de la herida, por ejemplo; la herida se sitúa al mismo nivel que la piel circundante, el lecho debe tener una tonalidad rojiza, y en los bordes de la herida aparece un epitelio rosado. La edad: la velocidad de cicatrización es inversamente proporcional a la edad del paciente, e incluso en niños se suele producir cicatrices hipertróficas.
La edad: la velocidad de cicatrización es inversamente proporcional a la edad del paciente, e incluso en niños se suele producir cicatrices hipertróficas.